Mieloma multiplo. Inquadramento diagnostico, clinico ed epidemiologico
Claudio Cerchione
IRCCS Istituto Romagnolo per lo Studio dei Tumori “Dino Amadori” – IRST, Meldola (FC)
Il mieloma multiplo (MM) è una patologia dell’anziano e ha un’incidenza lievemente maggiore negli uomini rispetto alle donne. Nelle fasi iniziali è spesso asintomatico, sebbene nella maggior parte dei pazienti vi siano segni e sintomi che ne indicano la presenza. La diagnosi accurata e tempestiva è fondamentale per impostare un corretto approccio di terapia, soprattutto alla luce dei nuovi trattamenti disponibili
Quali sono le discrasie plasmacellulari, e cosa è il mieloma multiplo?
La gammopatia monoclonale di incerto significato (Monoclonal gammopathy of undetermined significance, MGUS) è caratterizzata dalla presenza della proteina monoclonale (proteina M) senza evidenza di plasmacellule, sintomi o danno d’organo. Non si tratta di una patologia tumorale, ma di una condizione pre-neoplastica che non necessita di trattamento, ma soltanto di monitoraggio per valutarne l’eventuale progressione mielomatosa. La MGUS si osserva in circa il 3% dei soggetti di età superiore ai 50 anni e può progredire a mieloma o ad altre neoplasie correlate (percentuale dell’1% per anno).
Si definisce invece mieloma smoldering (indolente) il riscontro di proteina M nel siero e/o di plasmacellule nel midollo osseo, in quantità nettamente maggiore rispetto alla MGUS, ma senza evidenza di criteri CRAB (increased Calcium, Renal insufficiency, Anemia, Bone lesions – ipercalcemia, insufficienza renale, anemia e malattia ossea).
Nel mieloma sintomatico, mieloma multiplo (MM) sono invece presenti contemporaneamente: proteina M nel siero e/o nelle urine, plasmacellule clonali nel midollo e almeno uno dei criteri CRAB.
I numeri del mieloma multiplo
Il mieloma multiplo è al secondo posto fra le neoplasie ematologiche più frequenti dopo il linfoma non-Hodgkin ed è responsabile dell’1-2% di tutte le neoplasie e del 10-15% dei tumori ematologici. La malattia colpisce soprattutto gli anziani, con un’età media alla diagnosi di circa 70 anni (solo il 2% circa dei pazienti ha meno di 40 anni); inoltre, è leggermente più diffuso nel sesso maschile.
L’incidenza stimata è di circa 39.000 nuovi casi ogni anno in Europa, e la decima edizione de “I numeri del cancro in Italia”, pubblicata nel 2020 da AIRtum in collaborazione con AIOM, tra gli altri, ha riportato che nel nostro Paese ogni anno si stimano circa 5.700 nuovi casi di mieloma multiplo, con un’incidenza di 3.019 casi negli uomini e 2.740 nelle donne. In Italia, il mieloma multiplo rappresenta l’1,5% di tutti i tumori diagnosticati nella donna (7,7 casi ogni 100.000 abitanti per anno) e l’1,6% di tutti i tumori diagnosticati nell’uomo (11,1 casi ogni 100.000 abitanti per anno).
Il quadro clinico
Sebbene alcuni pazienti con mieloma multiplo siano asintomatici, specie nelle fasi iniziali della malattia, la maggior parte presenta segni e sintomi che ne indicano la presenza. Innanzitutto, la proliferazione massiccia delle plasmacellule causa una riduzione della normale funzione immunitaria e, quindi, una riduzione dei livelli di immunoglobuline e un aumento del rischio di infezioni, nonché un’insufficienza midollare con conseguente anemia, responsabile di stanchezza, debolezza, difficoltà respiratoria, e/o, più raramente, una riduzione dei globuli bianchi (leucopenia) o delle piastrine (trombocitopenia), che determina la minor resistenza alle infezioni e la facilità al sanguinamento anche in seguito a banali tagli.
Le lesioni ossee caratteristiche del mieloma multiplo provocano, inoltre, dolore osseo, che è il sintomo più comune della malattia, localizzato soprattutto a livello della schiena, dell’anca e del costato, nonché una maggiore fragilità dell’osso, che può rompersi anche in seguito a traumi lievi o andare incontro a fratture spontanee. Il dolore può anche essere di tipo nervoso (per esempio sciatica), determinato dallo schiacciamento dei nervi da parte delle ossa vertebrali. Inoltre, l’invasione dell’osso da parte delle cellule mielomatose può provocare rilascio di calcio nel sangue, con conseguente ipercalcemia, che a sua volta può essere responsabile di sintomi neurologici, quali debolezza e confusione mentale, e insufficienza renale, quest’ultima presente nel 20% dei casi già al momento della diagnosi.
La diagnosi
Gli esami di primo livello che possono fornire una prima indicazione sulla presenza del mieloma multiplo sono l’esame del sangue e quello delle urine: in caso di malattia, infatti, l’elettroforesi delle proteine del siero e delle urine evidenzia la presenza di livelli elevati di immunoglobuline. Altri esami fondamentali per la diagnosi sono la biopsia di sangue midollare (o la biopsia osteomidollare) e gli esami strumentali.
Tali indagini sono necessarie per definire i criteri di diagnosi. In particolare, l’International Myeloma Working Group (IMWG) per la diagnosi di MM utilizza criteri di laboratorio e criteri che valutano il danno d’organo. La diagnosi di MM richiede la presenza del seguente criterio: Cellule plasmatiche del midollo osseo ≥10% o plasmocitoma osseo o dei tessuti molli dimostrato dalla biopsia, più uno delle seguenti:
● Presenza di danno d’organo o di tessuto correlato (spesso richiamato dall’acronimo CRAB) – Il danno d’organo finale è suggerito da un aumento del livello di calcio nel plasma, insufficienza renale, anemia e lesioni ossee. In particolare, per i CRAB si usano le seguenti definizioni:
- Anemia: emoglobina <10 g/dL (<100 g/L) o >2 g/dL (>20 g/L) sotto la norma.
- Ipercalcemia: calcio sierico >11 mg/dL (>2,75 mmol/litro).
- Insufficienza renale: clearance della creatinina stimata o misurata <40 mL/min o creatinina sierica >2 mg/dL (177 micromol/litro).
- Lesioni ossee: una o più lesioni osteolitiche di dimensioni ≥5 mm su radiografia scheletrica, risonanza magnetica (MRI), tomografia computerizzata (CT) o tomografia a emissione di positroni/ tomografia computerizzata (PET/ CT).
● Presenza di un biomarcatore associato a una progressione di danno d’organo (spesso richiamato dall’acronimo SLiM, che rappresenta il Sixty, Light chain ratio, MRI); uno o più dei seguenti:
- ≥60% di plasmacellule clonali nel midollo osseo.
- Rapporto FLC coinvolto/non coinvolto di 100 o più (purché il livello FLC coinvolto sia almeno 100 mg/L).
- Risonanza magnetica con più di una lesione focale (che coinvolge l’osso o il midollo osseo).
Inoltre, i criteri IMWG consentono anche la diagnosi di MM smouldering (SMM) ovvero una condizione clinica compresa tra la MGUS e il MM clinicamente attivo. In particolare, il SMM si definisce in caso di componente monoclonale ≥3 g/ dl e/o dal 10 al 60% di plasmacellule del midollo osseo, ma nessun danno d’organo (lesioni litiche, anemia, malattia renale o ipercalcemia) che possa essere attribuito alla sottostante discrasia plasmacellulare, nessun myeloma-definig event, e nessuna amiloidosi.
Il decorso della malattia e la sua stadiazione clinica
Il mieloma multiplo si sviluppa a partire da una condizione premaligna, la gammopatia monoclonale di significato non determinato (MGUS), che progredisce verso il cosidetto mieloma multiplo ‘smoldering’ (SMM) e, infine, verso una condizione di mieloma multiplo attivo (FIGURA 1). Fin dall’inizio sono presenti nelle plasmacellule da cui prende origine la malattia alterazioni genetiche ed epigenetiche che sono alla base della sua progressione, tra cui iperdiploidia di cromosomi, traslocazioni nei geni delle catene pesanti delle immunoglobuline, disregolazione dei geni del ciclo cellulare, alterazioni del pathway di NFκB e pattern anomali di metilazione del DNA.
Figura 1 Storia naturale del mieloma multiplo
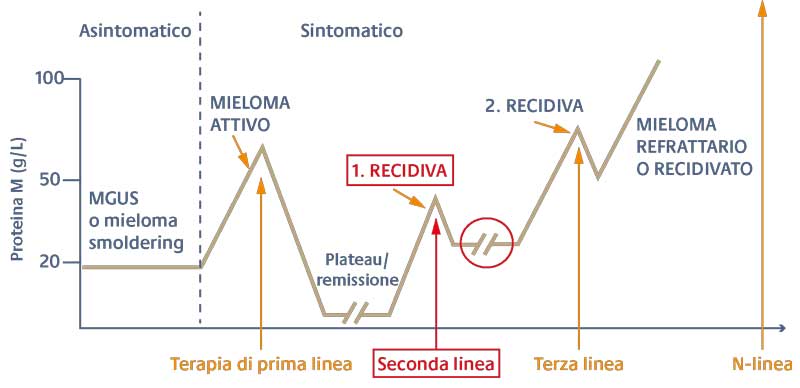
Quando il mieloma multiplo è asintomatico in genere non richiede un trattamento e, quindi, nemmeno la stadiazione della malattia e le analisi citogenetiche. Viceversa, in presenza di sintomi va avviata una terapia e servono informazioni sullo stadio della malattia. Tali informazioni, infatti, sono importanti per selezionare il trattamento più adatto al caso specifico. Più basso è lo stadio, migliore sarà la prognosi del paziente. Il sistema di stadiazione attualmente più utilizzato è quello dell’International Staging System revisionato (R-ISS), basato sui livelli sierici di albumina e di beta-2-microglobulina, sul rischio citogenetico valutato mediante ibridazione fluorescente in situ (FISH) e sui livelli di lattico deidrogenasi (LDH) (TABELLA 1).
Tabella 1 Il sistema di stadiazione R-ISS
per il mieloma multiplo

La valutazione del rischio citogenetico è importante poiché è noto che alcune anomalie genetiche (alcune traslocazioni, delezioni e amplificazioni di porzioni di cromosomi) sono associate a risposte terapeutiche più scadenti. A causa del loro valore prognostico e della diffusa disponibilità di sonde per FISH, t(4;14), t(14;16) e 17p, tali alterazioni sono considerate ad alto rischio nel R-ISS, riconosciuto come score prognostico per la stratificazione del rischio nel MM.
La terapia del mieloma multiplo: grandi progressi, ma anche bisogni da colmare
La terapia del mieloma multiplo negli ultimi anni ha subito una vera e propria rivoluzione, con significativi miglioramenti sia in termini di outcome che di compliance del paziente – sia di nuova diagnosi che recidivato – grazie all’introduzione di nuove categorie farmacologiche come gli inibitori del proteosoma (PI), di prima (bortezomib) e soprattutto seconda generazione (carfilzomib, ixazomib), i farmaci immunomodulanti (IMIDs) (talidomide, lenalidomide e pomalidomide), gli anticorpi monoclonali (daratumumab ed elotuzumab) e gli inibitori delle istone deacetilasi (HDAC) (panobinostat). Questi nuovi farmaci (FIGURA 2) hanno mostrato un notevole miglioramento sia della sopravvivenza libera da progressione che della sopravvivenza globale, insieme ad un’ottima tollerabilità, che consente la terapia continuativa (fino a progressione), con un controllo continuo della patologia.
Figura 2 Evoluzione della terapia
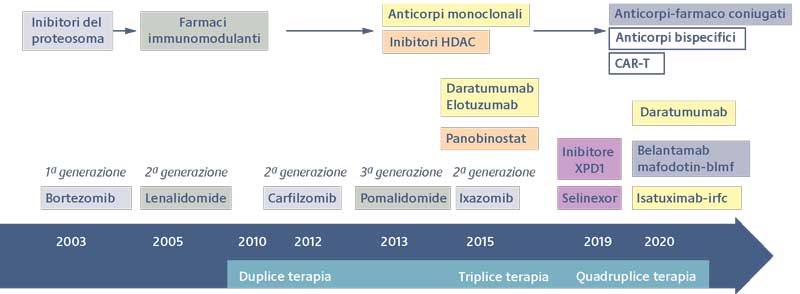
Alla luce dell’avvento dei nuovi farmaci, occorre oggi delineare fin dall’inizio la migliore sequenza terapeutica personalizzata (e le corrette combinazioni farmacologiche), grazie ad una corretta profilazione clinico-biologica del paziente, con risultati così incoraggianti da poter sognare un’epoca in cui l’utilizzo del trapianto autologo di midollo osseo (e le complicanze ad esso correlate) prima al centro della terapia del mieloma del giovane, si ridurrà fino a sparire. Di pari passo al perfezionamento terapeutico, cresce sempre più la comprensione e conoscenza della biologia del tumore, che costituisce la base razionale per lo sviluppo di nuove opzioni farmacologiche e di nuove combinazioni terapeutiche. Gli studi riguardanti il profilo biologico confermano che il mieloma è una patologia eterogenea, suggerendo sempre più, per il perfezionamento della gestione del paziente, la necessità di approcci adattati al rischio e alla personalizzazione del trattamento. Grazie ai brillanti risultati ottenuti dalla ricerca, i tassi di sopravvivenza raggiunti in questa patologia sono tanto incoraggianti da permettere di pensare finalmente alla cura per una malattia che prima era considerata incurabile.
Il trattamento di prima linea
Il trattamento di prima linea differisce a seconda che il paziente sia candidabile o meno al trapianto di cellule staminali, per lo più autologo. Possono essere sottoposti a questa procedura e a un trattamento più aggressivo i soggetti con meno di 65 anni o, se privi di comorbilità, anche di 70-72 anni. Per entrambe le categorie di pazienti vi è stata una recente rivoluzione, con l’integrazione del daratumumab come nuovo backbone, con un incredibile miglioramento in termini di efficacia e tollerabilità.
Nei soggetti candidabili al trapianto, il trattamento inizia con la terapia di induzione, finalizzata a ridurre la massa tumorale e alleviare i sintomi, e basata su una combinazione di farmaci, comprendente in genere uno steroide ed eventualmente farmaci chemioterapici e, sempre di più, farmaci innovativi. L’induzione solitamente non richiede il ricovero ed è ben tollerata; una volta terminata, in assenza di controindicazioni, si può procedere con il trapianto, preceduto da una terapia mieloablativa per preparare al trapianto.
Nei casi in cui il trapianto non è praticabile, che sono la maggioranza, la terapia di prima linea consiste nell’utilizzo di farmaci immunomodulanti e anticorpi monoclonali, spesso in combinazione, al fine di ridurre il più possibile e per il maggior tempo possibile il carico di malattia, mantenendo un’adeguata qualità di vita.
La malattia recidivata/refrattaria
I miglioramenti della sopravvivenza nei pazienti affetti da mieloma multiplo sono stati ottenuti anche grazie al notevole progresso avvenuto negli ultimi anni delle terapie disponibili per la recidiva di malattia. Dagli anni 2000 a oggi sono stati approvati molti farmaci nuovi, efficaci e ben tollerati, che si utilizzano per lo più in associazione, fino alla progressione o alla comparsa di un’eventuale intolleranza da parte del paziente, allo scopo di ottenere una remissione della malattia più duratura possibile, a fronte di limitati effetti collaterali. La quota di pazienti trattati con farmaci innovativi è passata dall’8,7% nel 2000 al 61,3% nel 2014 e si è assistito di pari passo a un notevole miglioramento degli outcome. Uno studio ha evidenziato nei pazienti in cui la malattia è stata diagnosticata nel 2012 una probabilità di sopravvivenza 1,25 volte maggiore rispetto a quelli diagnosticati nel 2006.
Molti dei progressi iniziali sono stati ottenuti grazie all’incorporazione di agenti innovativi come gli IMiDs e i PI nei regimi terapeutici per il mieloma multiplo. Successivamente, lo sviluppo degli anticorpi monclonali diretti contro antigeni espressi sulla superficie delle plasmacellule, come il CD38, ha portato a una nuova rivoluzione e a un ulteriore miglioramento degli outcome.
La rivoluzione è sicuramente avvenuta con l’avvento del daratumumab, anticorpo monoclonale anti-CD38, nelle combinazioni con bortezomib-desametasone e lenalidomidedesametasone, e con il carfilzomib, inibitore del proteosoma di seconda generazione, come single agent o in combinazione a lenalidomide-desametasone.
La recente approvazione di isatuximab, anticorpo monoclonale anti-CD38 di nuova generazione, ha colmato diversi unmet clinical need, grazie alle approvazioni in combinazione con carfilzomib-desametasone per pazienti a partire dalla seconda linea di trattamento, e in combinazione con pomalidomidedesametasone a partire dalla seconda linea di trattamento: emergono quindi nuovi backbones anche nel paziente con malattia recidivata-refrattaria.
Nonostante tali avanzamenti, la maggior parte dei pazienti finisce prima o poi per sviluppare resistenze alle terapie che rappresentano l’attuale standard terapeutico, inclusi i farmaci innovativi, e la recidiva rappresenta purtroppo un evento inevitabile. Sebbene trattabile, il mieloma multiplo è ancora considerato, nella stragrande maggioranza dei casi, una malattia incurabile, perché cloni di plasmacellule mielomatose resistenti ai farmaci emergono e si evolovono di continuo. In molti pazienti si osserva la persistenza di una malattia minima residua (MRD) dopo il trattamento, che aumenta il rischio di recidiva e progressione, ma persino coloro che raggiungono l’MRD-negatività grazie alla terapia possono andare incontro a una ricaduta. Inoltre, i pazienti con mieloma multiplo ricaduto/refrattario mostrano una durata della remissione progressivamente inferiore e risposte sempre minori al trattamento dopo ogni ricaduta. Ciò rende necessaria una continua ricerca di nuovi approcci terapeutici, più efficaci, meglio tollerati e in grado di migliorare gli outcome e superare tali resistenze. Negli ultimi anni, in particolare, sono emersi nuovi sottogruppi di pazienti refrattari a tutte e tre le classi di farmaci innovativi (IMiD, PI e anticorpi monoclonali) definiti triplo-refrattari, e addirittura pazienti quadri-refrattari (refrattari a un anticorpo monoclonale, un IMiD e due PI oppure a un anticorpo monoclonale, due IMiD e un PI) o penta-refrattari (refrattari a un anticorpo monoclonale, due IMiD e due PI). Per questi pazienti altamente pretrattati, per i quali non è stato ancora definito un chiaro paradigma di trattamento e restano poche opzioni terapeutiche disponibili, la prognosi è molto sfavorevole, con una sopravvivenza inferiore all’anno. In un’analisi retrospettiva del 2016 su pazienti triplo-refrattari, per esempio, la sopravvivenza globale (OS) è risultata di circa 8 mesi. In un’analisi successiva del 2018, pazienti penta-refrattari trattati con bortezomib, lenalidomide, carfilzomib, pomalidomide e desametasone hanno mostrato un’OS mediana di 5,6 mesi.
Pertanto, in particolare per questa popolazione di pazienti, caratterizzata da un forte unmet need, vi è urgente bisogno di ulteriori strategie terapeutiche innovative e più efficaci. Proprio la ricerca di tali terapie è diventata negli ultimi tempi una priorità chiave della ricerca sul mieloma multiplo. In questo contesto, l’antigene di maturazione delle cellule B (BCMA) rappresenta un nuovo ed eccellente bersaglio per l’immunoterapia nel mieloma multiplo: le terapie che hanno come target il BCMA hanno diversi potenziali meccanismi d’azione, compresi gli anticorpi bispecifici T-cells engagers (BITE), i farmaci coniugati anticorpo-farmaco (ADC) e, infine, la terapia con cellule T con recettore dell’antigene chimerico (CAR T). L’interesse per il BCMA quale target terapeutico è fortemente guidato dal suo profilo di espressione più selettivo rispetto a quello degli antigeni CD38 e SLAMF7, bersaglio degli anticorpi monoclonali già in uso daratumumab, isatuximab ed elotuzumab.
Si sta pertanto assistendo a un rapido sviluppo di nuovi agenti diretti contro questo nuovo target, soprattutto alla luce dei primi risultati impressionanti ottenuti nei pazienti con mieloma multiplo ricaduto/refrattario trattati con le prime CAR-T anti-BCMA. Al momento sono in sperimentazione diversi tipi di terapie dirette contro il BCMA per i pazienti con mieloma multiplo, ma le principali sono tre: gli ADC, le cellule CAR-T e gli anticorpi bispecifici. Belantamab mafodotin, complesso coniugato anticorpo-farmaco, ha recentemente ottenuto indicazione nei pazienti a partire dalla quinta linea di trattamento, grazie ai promettenti risultati in una popolazione particolarmente ostica da trattare, che aveva fallito tutte le opportunità terapeutiche disponibili nella pratica clinica: ciò pone la base per i trials in corso, con innovative combinazioni belantamab-based.
Bibliografia
Cerchione C, Usmani SZ, Stewart AK, Kaiser M, Rasche L, Kortüm M, Mateos MV, Spencer A, Sonneveld P, Anderson KC. Gene Expression Profiling in Multiple Myeloma: Redefining the Paradigm of Risk-Adapted Treatment. Front Oncol. 2022 Feb 8;12:820768. doi: 10.3389/fonc.2022.820768. eCollection 2022. PMID: 35211412.
Martino M, Canale FA, Alati C, Vincelli ID, Moscato T, Porto G, Loteta B, Naso V, Mazza M, Nicolini F, Ghelli Luserna di Rorà A, Simonetti G, Ronconi S, Ceccolini M, Musuraca G, Martinelli G, Cerchione C. CART-Cell Therapy: Recent Advances and New Evidence in Multiple Myeloma. Cancers (Basel). 2021 May 27; 13(11): 2639. doi: 10.3390/cancers13112639. PMID: 34072068 Free PMC article.
Cerchione C, Nappi D, Martinelli G. Pegfilgrastim for primary prophylaxis of febrile neutropenia in multiple myeloma. Support Care Cancer. 2021 Nov;29(11):6973-6980. doi: 10.1007/s00520- 021-06266-x. Epub 2021 May 14. PMID: 33990881.
Offidani M, Corvatta L, Morè S, Nappi D, Martinelli G, Olivieri A, Cerchione C. Daratumumab for the Management of Newly Diagnosed and Relapsed/Refractory Multiple Myeloma: Current and Emerging Treatments. Front Oncol. 2021 Feb 17;10:624661. doi: 10.3389/fonc.2020.624661. eCollection 2020. PMID: 33680948.
Matteucci F, Paganelli G, Martinelli G, Cerchione C. PET/CT in Multiple Myeloma: Beyond FDG. Front Oncol. 2021 Jan 25;10:622501. doi: 10.3389/fonc.2020.622501. eCollection 2020. PMID: 33569348.
Bolli N, Martinelli G, Cerchione C. The molecular pathogenesis of multiple myeloma. Hematol Rep. 2020 Dec 18;12(3):9054. doi: 10.4081/hr.2020.9054. eCollection 2020 Dec 2. PMID: 33408844.
Martino M, Paviglianiti A, Memoli M, Martinelli G, Cerchione C. Multiple Myeloma Outpatient Transplant Program in the Era of Novel Agents: State-of-the-Art. Front Oncol. 2020 Nov 11;10:592487. doi: 10.3389/fonc.2020.592487. eCollection 2020. PMID: 33262948 Free PMC article.
Derudas D, Capraro F, Martinelli G, Cerchione C. How I manage frontline transplant-ineligible multiple myeloma. Hematol Rep. 2020 Sep 21;12(Suppl 1):8956. doi: 10.4081/hr.2020.8956. eCollection 2020 Sep 21. PMID: 33042505.
Lee HC, Cerchione C. How I treat relapsed and/or refractory multiple myeloma. Hematol Rep. 2020 Sep 21;12(Suppl 1):8955. doi: 10.4081/hr.2020.8955. eCollection 2020 Sep 21. PMID: 33042504.
Montefusco V, Martinelli G, Cerchione C. How I manage frontline transplant-eligible multiple myeloma in Italy. Hematol Rep. 2020 Sep 21;12(Suppl 1):8954. doi: 10.4081/hr.2020.8954. eCollection 2020 Sep 21. PMID: 33042503.
Romano A, Cerchione C, Conticello C, Martinelli G, Di Raimondo F. How we manage smoldering multiple myeloma. Hematol Rep. 2020 Sep 21;12(Suppl 1):8951. doi: 10.4081/ hr.2020.8951. eCollection 2020 Sep 21. PMID: 33042502.
Cerchione C, Martinelli G. Multiple myeloma in 2020: state of the art. Panminerva Med. 2020 Dec;62(4):191-192. doi: 10.23736 S0031-0808.20.04159-2. Epub 2020 Sep 22. PMID: 32957745
Montefusco V, Mussetti A, Salas MQ, Martinelli G, Cerchione C. Old and new generation proteasome inhibitors in multiple myeloma. Panminerva Med. 2020 Dec;62(4):193-206. doi: 10.23736/ S0031-0808.20.04148-8. Epub 2020 Sep 22. PMID: 32957744.
Vozella F, Fazio F, Lapietra G, Petrucci MT, Martinelli G, Cerchione C. Monoclonal antibodies in multiple myeloma. Panminerva Med. 2021 Mar;63(1):21-27. doi: 10.23736/S0031- 0808.20.04149-X. Epub 2020 Sep 21. PMID: 32955188.
Nicolini F, Bravaccini S, Mazza M, Gruszka AM, Tazzari M, MartÍn-Antonio B, Juan M, Ibrahim T, Maltoni R, Martinelli G, Cerchione C. CAR T cells targeting options in the fight against multiple myeloma. Panminerva Med. 2021 Mar;63(1):37-45. doi: 10.23736/S0031-0808.20.04146-4. Epub 2020 Sep 21. PMID: 32955187.
Gentile M, Morabito F, Martino M, Vigna E, Martino EA, Mendicino F, Martinelli G, Cerchione C. Chemotherapy-based regimens in multiple myeloma in 2020. Panminerva Med. 2021 Mar;63(1):7-12. doi: 10.23736/S0031-0808.20.04145-2. Epub 2020 Sep 21. PMID: 32955186.
Martino M, Paviglianiti A, Gentile M, Martinelli G, Cerchione C. Allogenic stem cell transplantation in multiple myeloma: dead or alive and kicking? Panminerva Med. 2020 Dec;62(4):234-243. doi: 10.23736/S0031-0808.20.04142-7. Epub 2020 Sep 21. PMID: 32955185.
Romano A, Santoro M, Conticello C, Siragusa S, DI Raimondo F, Martinelli G, Cerchione C. Post-transplant consolidation based on combination of lenalidomide and proteasome inhibitors in multiple myeloma. Panminerva Med. 2021 Mar;63(1):13-20. doi: 10.23736/S0031-0808.20.04141-5. Epub 2020 Sep 21. PMID: 32955184.
Santoro M, Romano A, Mancuso S, Siragusa S, DI Raimondo F, Martinelli G, Cerchione C. Prevention of venous thromboembolic events occurring in myeloma patients treated with secondgeneration novel agents. Panminerva Med. 2021 Mar;63(1):1-6. doi: 10.23736/S0031-0808.20.04133-6. Epub 2020 Sep 21. PMID: 32955183.
Derudas D, Capraro F, Martinelli G, Cerchione C. Old and new generation immunomodulatory drugs in multiple myeloma. Panminerva Med. 2020 Dec;62(4):207-219. doi: 10.23736/S0031- 0808.20.04125-7. Epub 2020 Sep 21. PMID: 32955182.
Chen Y, Nagarajan C, Tan MS, Martinelli G, Cerchione C. BCMA-targeting approaches for treatment of multiple myeloma. Panminerva Med. 2021 Mar;63(1):28-36. doi: 10.23736/S0031- 0808.20.04121-X. Epub 2020 Sep 21. PMID: 32955181.
Nagarajan C, Tan MS, Chen Y, Martinelli G, Cerchione C. Current and future perspectives of maintenance therapy in multiple myeloma. Panminerva Med. 2020 Dec; 62(4): 225-233. doi: 10.23736/S0031-0808.20.04117-8. Epub 2020 Sep 21. PMID: 32955180.
Ricciuti G, Falcone A, Cascavilla N, Martinelli G, Cerchione C. Autologous stem cell transplantation in multiple myeloma. Panminerva Med. 2020 Dec;62(4):220-224. doi: 10.23736/S0031- 0808.20.04114-2. Epub 2020 Sep 21. PMID: 32955179.


